이버멕틴의 항암제로의 약물 재개발 가능성
이버멕틴의 항암제로의 약물 재개발 가능성
이버멕틴은 구충제로 이미 오랜동안 사용된 약물로 다양한 신약으로 재개발하려는 노력이 줄곧 전개되어 왔다. 최근에는 이를 코로나19 치료제로 재활용(Repositioning of drug)하려는 시도도 이루어져 왔는데 상당한 긍정적 의견이 모아져 왔다(참조. 이버멕틴은 코로나19 치료제가 될 수 있을까). 이와 함께 이버멕틴이 갖는 항종양 효과라는 약동학적 입론을 기초로 이를 항암제로 재개발하려는 임상연구가 이루어져 온 것은 상당한 역사를 갖는다. 이 글은 이들 연구에 대해 약리적 작용에 대한 종합적인 정리 및 개별 암에서의 작용 그리고 그간에 이뤄져온 임상연구 등에 대해 체계적으로 정리하며, 항암제로 재개발하는 보다 본격적인 임상연구를 제안한다. 향후 이에 대해 이루어져 온 임상연구들에 대해 재검토하는 기회를 가지려 한다. 참고하시기 바랍니다.
Ivermectin : 새로운 항암제로서의 다목적 구충제의 재개발 가능성
Ivermectin: Potential Repurposing of a Versatile Antiparasitic as a Novel Anticancer
Drug Repurposing - Molecular Aspects and Therapeutic Applications
2021 September 1st, 2021
By Alfonso Dueñas-González and Mandy Juárez-Rodríguez
(https://www.intechopen.com/online-first/78376)
요약
약물 재개발(Drug repositioning)은 기존 화합물에 대한 새로운 작용 기전 및 적응증의 확인을 기반으로 항암제를 발견하고 개발하는 대체 전략이다. Ivermectin은 1967년에 발견되고 1987년 이후 사람에 대한 사용이 FDA에 의해 승인된, 일련의 16-membered macrocyclic lactone moietiesdls, avermectin 화합물 그룹에 속한다. 여기에서 우리는 다양한 종양 유형에 대해 항종양 효과를 발휘하는 다중 표적 항암제로서의 이버멕틴의 잠재력을 보여주는 시험관내 및 생체내 증거를 요약한다. 특히, 이버멕틴의 시험관 내 및 생체 내 항종양 활성은 임상 연구에서 수행된 인간 약동학 연구를 기반으로 임상적으로 달성할 수 있는 농도에서 달성된다. 더욱이, 용도가 변경된 이버멕틴의 안전성은 최근 COVID-19에 대한 임상 연구에서 잘 확립되었다. 결과적으로, 우리는 이버멕틴이 암에 재사용될 수 있는 우수한 잠재적 후보 약물이며 잘 설계된 임상시험을 통해 다양한 암에 대한 엄격한 평가를 받을 가치가 있다고 믿는다.
1. 도입
Avermectin은 방선균 S. avermitilis의 토양 발효에서 생성되는 16원 거대고리 락톤의 복합체(a complex of 16-membered macrocyclic lactones)이다[ 1 , 2 ]. 아버멕틴은 8가지 화합물(A1a, A1b, A2a, A2b, B1a, B1b, B2a, B2b)이 존재하며, 이 중 이버멕틴은 반합성 혼합물(80% B1a 및 20% B1b)로 인해 가장 일반적으로 사용되며, 강력한 구충 작용과 안전성을 보인다[ 3 ]. Ivermectin이 파생된 화합물 계열은 1970년대 노벨상 수상자인 Satoshi Omura와 William Campbell에 의해 발견되었다. 이 화학물질은 곤충의 세포막을 통한 체액 교환을 방해하여 개에서 요충, 진드기, 이, 심장사상충 및 벼룩과 같은 다양한 기생충 및 절지동물에 대해 효과적이며, 지난 40년 동안 이버멕틴은 농업 및 수의학 목적으로 광범위하게 사용되었다[ 4, 5 , 6 , 7 ].
구충제로서의 이버멕틴 치료의 성공은 기생충 세포에 존재하지만 척추동물에는 없는 글루타메이트-관문 염화물 채널(Glu-Cl)에 대한 높은 친화성 때문이다. 이버멕틴-채널-상호작용은 채널 폐쇄를 방지하여 원형질막 과분극을 유발하고 표적 기생충의 인두 및 체세포 근육을 마비시켜 죽음을 유도한다[ 2]. Glu-Cl 기생충 채널을 활성화하는 것 외에도, 이버멕틴은 γ-아미노부티르산 A형 수용체(GABA 수용체), 글리신 수용체, 뉴런 α7- 니코틴 수용체 및 퓨린성 P2X4 수용체를 포함한 여러 척추 동물 리간드 개폐 경로의 용량 의존적인 양성 알로스테릭 조절기로써 역할한다. 이들 수용체에 대한 ivermectin의 효과에는 낮은 농도에서 작용제 유도 전류의 강화와 높은 농도에서 채널 개방이 포함된다[ 8 ]. 그러나 GABA에 민감한 뉴런은 중추신경계 내의 혈액-뇌 장벽에 의해 보호되어 Ivermectin의 잠재적으로 해로운 영향으로부터 척추동물을 보호한다[ 3 , 6 ].
2. 암 치료에서의 약물 용도 변경( Drug repurposing)
암 사망률을 줄이기 위해서는 효과적이고 안전하며 저렴한 항암제가 절실히 필요하다. 약물 용도 변경 분야는 기존 약물 발견 모델의 대안으로 1990년대 초에 등장했다. 이 모델에는 표적 발견 및 검증, 고처리량 스크리닝을 통한 리드 식별, 의약 화학에 의한 리드 최적화가 포함된다. 의약품 개발에 오랜 시간과 막대한 자금이 필요한 제약업계의 제한된 생산성을 극복하기 위해 의약품 용도변경이 급증했다. 전통적인 방식으로 약물을 개발하는데는 평균 15년의 연구가 필요한 반면, 용도 변경을 통한 약물 개발은 더 저렴하고 빠르고 안전할 것으로 기대된다. 약물 용도 변경의 중요한 이점은 약물의 약동학, 약력학 및 독성 프로필이 일반화되어 있다는 점이다. 따라서 2상 및 3상 임상시험으로의 신속한 전환이 가능하다.[9]. 현재 이러한 재개발에 초점을 두고 연구되고 있는 다양한 약물 중에서 이버멕틴이 특히 유망하다. 시험관 내 및 생체 내 시험에서 이버멕틴이 항종양 효과가 있는 것으로 밝혀졌다( 그림 1 ).
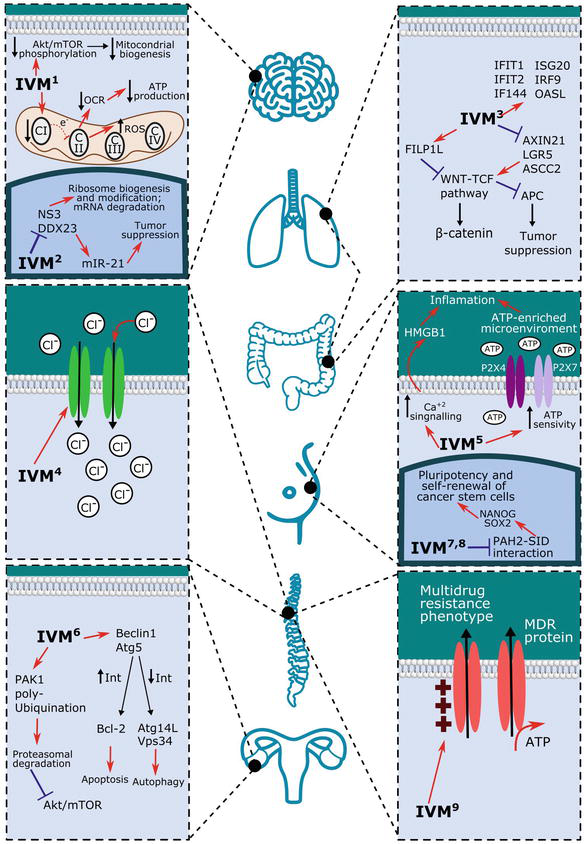
그림 1. 이버멕틴의 암 표적.
1. 이버멕틴은 미토콘드리아 복합체 I의 기능을 감소시켜 세포에 대한 ATP를 생성하기 위해 산소 소비율을 자극하는 산화적 인산화 경로의 전자 운동을 제한한다. 낮은 ATP 수준은 P-당단백질 펌프가 화학요법 약물을 밀어내지 못하는 것과 관련이 있다. 이와 동시에 Akt의 인산화 수준이 감소하여 미토콘드리아 생합성 과정에 영향을 미친다. 또한, 미토콘드리아 기구에서의 변화는 DNA를 손상시키는 활성산소 종의 증가된 수준과 관련이 있다.
2. Ivermectin은 RNA helicase NS3 및 DDX23의 기능을 제한하는데, 이들 둘은 모두 리보솜 생합성 및 전사 후 변형, mRNA 분해와 관련이 있다. DDX23은 miR-21의 프로모터로 작용하며, 이것은 종양 진행의 잘 알려진 자극제이다.
3. 암 진행 및 전이에 관여하는 WNT-TCF 경로는 Ivermectin에 의해 억제된다. 실제로 이 화합물은 WNT-TCF 표적인 AXIN2, LGR5 및 ASCL2를 억제한다. 동시에 FILIP1L 신호를 보내는 WNT의 억제인자를 촉진한다. 두 효과 모두 WNT-TCF가 종양 억제인자 APC를 하향 조절하는 능력을 억제하고 전이성 사건에서 상피에서 중간엽으로의 전이를 위해 β-카테닌의 핵으로의 전위를 제한한다.
4. Ivermectin은 염화물 채널의 상향 조절에 의해 이온 전달물질로 작용하여 세포 사멸 및 삼투 세포 사멸을 생성한다.
5. Ivermectin은 염증을 촉진하는 ATP 및 HMGB1이 풍부한 미세환경을 자극하여 면역원성 세포 사멸을 유도한다. 이 약물은 또한 P2X 막 수용체, 특히 P2X4 및 P2X7에서 ATP 감수성과 칼슘 신호를 증가시켜 ATP 의존성 면역 반응을 유도한다.
6. 이버멕틴은 키나제 PAK1의 폴리유비퀴틴화를 촉진하여 프로테아좀에서 분해되도록 한다. 결함이 있는 PAK1은 차례로 Akt/mTOR 경로를 억제한다. 동시에 Ivermectin은 autophagy의 유도와 관련된 Beclin1과 Atg5의 발현을 자극한다. 특히 Beclin1은 양성자가포식조절인자 Atg14L과 Vps34의 발현을 증가시키고 Bcl-2의 세포사멸의 음성조절인자를 감소시킨다. 함께 이것은 autophagy와 apoptosis를 생성한다.
7,8. Ivermectin은 ca의 PAH2 모티프에 결합하는 SIN3-상호작용을 모방할 수 있는 능력으로 인해 악성 세포의 후생유전적 특징과 자가 재생 활성을 수정한다.
3. 이버멕틴 작용기전의 항종양 효과 및 시험관 내 데이터
Ivermectin은 다양한 유형의 암에서 항종양 효과를 입증했다. 보고된 작용 기전 중 이버멕틴은, 1) 미토콘드리아 I 복합체, 다제내성 단백질(MDR), 2) RNA 헬리카제, 3) WNT-TCF 경로, 4) 염화물 채널 수용체, 5) ATP- 및 HMGB1을 통한 면역원성 세포 사멸, 6) PAK-1, 7,8) 줄기세포의 후성 유전적 특징 및 자가 재생 등의 기능과 상호 작용하고 영향을 미친다.[10]. 전임상 테스트에서 세포 성장 억제, 다양한 암세포주에서 세포자멸사 유도, 쥐 모델에서 항종양 효과가 입증되었다( 그림 1 ) [ 11 , 12 , 13 , 14 , 15 , 16 , 17, 18 , 19 ]. 그만큼 시험관 내 항종양 효과는 5μM(0.01-100μM)의 중앙 농도에서 관찰되었으며, 이는 표 1에 표시된 인간의 약동학 데이터에 따라 임상적으로 달성할 수 있다. 아래에서 다양한 암세포주에 대한 이버멕틴의 실험실 결과에 대한 검토를 제시한다.
*표 1 이버멕틴으로 인한 부작용
| 질병/부작용 | 경증 | 중등증 | 중증 |
| 사상충증 | 근육통, 피부 발진, 관절 부종, 팔다리 또는 얼굴, 가려움증, 발열 및 감기 | 피부통 및 부종, 관절통, 골통, 심한 현기증, 고열, 호흡곤란, 저혈압 | 없음 |
| 사상충증 | 두통과 메스꺼움 | 없음 | 뇌병증 |
| 개선충 | 메스꺼움 | 심한 두통, 복통 및 빈맥 | 없음 |
3.1 난소암
Ivermectin은 인간 난소암과 NF2가 결핍된 Schwannoma 세포주에서 발암성 키나제 PAK1을 차단하여 5~20μM 사이의 절반 최대 억제 농도(IC50)에서 세포 배양에서 PAK1 의존적 성장을 억제한다[ 14 ]. PAK1은 세포골격 역학, 세포 부착, 이동, 증식, 세포자멸사 및 유사분열에 필수적인 역할을 하는 다양한 신호 전달경로에 관여한다. 신생물의 약 70% 성장에 필요하다[ 20 ]. 또한, 5μM 이버멕틴으로 처리된 SKOV-3 세포주에서 파생된 암 줄기 유사 세포는 세포 생존력과 클론 생성 능력에서 상당한 감소를 보였다. 또한 ivermectin 5μM을 처리한 후 Nanog, Sox2 및 Oct4의 발현 수준이 감소했다[ 11 ].
3.2 유방암
Ivermectin은 PAK1의 유비퀴틴화를 촉진하여 유방암 세포주에서 ATK/mTOR 경로를 억제한다. Ivermectin은 PAK1 단백질과 AKT의 결합을 방해하고 차례로 AKT의 인산화 및 활성화를 방해한다. 그 결과 AKT/mTOR 경로가 비활성화된다. 이버멕틴의 이러한 효과는 10μM 이상의 농도에서 관찰된다[ 15 ]. 또한, 이버멕틴은 0.2-8μM 범위에서, mRNA와 단백질 수준 모두에서 다발성 및 자가 재생 마커 Nanog, Oct4, Sox2의 유지 발현을 감소시킴으로써, 암 줄기 유사 세포 농축 집단(CD44+/CD24-)의 생존 능력을 우선적으로 억제한다. [ 11 ]. 이와는 별도로 한 연구에서는 1μM 이버멕틴 치료가 SIN3의 기능을 억제하는 것으로 나타났다[ 16], 이는 Nanog와 Sox2를 긍정적으로 조절하여 맘모스피어 수를 감소시키는 복합체의 일부이다[ 21 ]. 또한, 이버멕틴은 삼중 음성 유방암 모델에서 E-카드헤린 및 에스트로겐 수용체 1 발현 및 타목시펜 감수성 회복을 유도하는 것으로 보고되었다. 이러한 관찰에 따르면 이버멕틴은 삼중 음성 유방암에서 잠재적인 항종양 효과가 있다[ 16 ]. 또 다른 연구에서는 에스트로겐 수용체 음성 유방암 세포에서 이버멕틴과 도세탁셀 또는 사이클로포스파미드와의 시너지 효과와 에스트로겐 수용체 양성 유방암 세포주에서 타목시펜과의 시너지 효과를 입증한 바 있다[ 22 ].
3.3 간암
인간 결합 간세포-담관암종 및 간내 담관암종(cHC-CC 및 ICC)에서 강력한 YAP1 활성화가 있다. YAP1은 세포 증식 및 세포 사멸 유전자 억제에 관여하는 유전자의 전사 조절자이며, 종양 억제를 허용하는 히포 신호 경로(Hippo signaling pathway)에서 억제된다. YAP1/TAZ의 핵 전위는 또한 TGF-β의 전사를 증가시킨다[ 23 ]. 따라서 YAP1/TAZ 및 TGF-β 신호전달의 조정된 표적화는 조절되지 않은 Hippo 신호전달을 나타내는 cHC-CC 및 ICC에 대한 치료로 작용할 수 있으며, 약물 스크리닝에서 이버멕틴이 YAP1 활성화를 억제한다는 것이 밝혀졌다[ 23 ].
3.4 자궁경부암
Ivermectin은 HeLa 세포의 생존력을 억제하고 G1/S 세포 주기 정지를 유도하여 세포 사멸과 DNA 단편화의 형태학적 변화 및 이러한 세포의 염색질 응축을 유도한다. 또한 이버멕틴은 세포 내 ROS 함량을 크게 증가시키고 HeLa 세포의 이동을 억제할 수 있다[ 24 ].
3.5 교모세포종
Ivermectin은 시험관 내 및 생체 내에서 세포 주기 정지 및 세포 사멸을 유도하여 신경교종 세포의 성장을 억제한다[25]. 특히, 교모세포종 및 뇌 내피세포에서 이버멕틴은 미토콘드리아 기능 장애를 유발하는 것으로 보고되었다. 그것은 세포 성장과 집락 형성을 억제하고 호흡 사슬 복합체 I의 효소 활성을 차단하여 미토콘드리아 호흡, 막 전위 및 ATP 수준을 감소시키는 동시에 caspase 의존적 세포 사멸을 유도하는 과산화물의 생성을 증가시킨다. 또한 이버멕틴은 5μM 이상의 농도에서 혈관신생을 억제한다[ 12 ].
3.6 백혈병과 전립선암
OCI-AML2 세포를 이버멕틴으로 처리하면 세포 내 염화물 이온 농도가 증가하여 혈장과 미토콘드리아 막의 과분극과 ROS 생성이 발생한다[ 18 ]. 대조적으로, 이버멕틴에 내성이 있는 DU145 및 PPC-1 세포 및 1차 정상 조혈세포는 최대 6 μM 이버멕틴으로 처리했을 때 원형질막 전위의 변화를 나타내지 않았다. 더욱이, 시험관 내 5μM 농도에서 다양한 암세포주에 대한 이버멕틴의 항종양 효과는 DU145가 생존 능력과 클론 생성 능력에서 최소한으로 감소하는 것으로 나타났지만 도세탁셀 세포와 함께 치료할 때 강력한 억제를 보여주었다[ 22 ]. 골수성 백혈병 세포에서 이버멕틴은 다우노루비신 및 시타라빈과 강력한 상승 작용을 발휘한다[ 18 ].
3.7 결장암과 폐암
WNT/TCF 신호 전달 경로는 많은 종양에서 구성적으로 활성화되며 세포 성장 및 증식을 위한 유전자를 조절한다. 이버멕틴은 이 경로의 직접적인 표적인 사이클린 D1을 감소시켜 WNT-TCF 신호 전달 경로를 억제할 수 있으며, 이버멕틴은 또한 β-카테닌의 인산화에 영향을 미치며, 이는 5μM 이상 농도에서 폐 및 결장 종양 세포의 증식 억제 및 세포자멸사 증가로 이어진다. [ 13 ].
4. 이버멕틴 동물 데이터의 항종양 효과
광범위한 전임상 연구에서 교모세포종, 백혈병, 유방암 및 결장암의 인간 이종이식편의 설치류 모델과 동계 모델의 다양한 뮤린 세포주에서 이버멕틴이 5mg/Kg의 중앙값 용량에서 강력한 항종양 효과를 갖는 것으로 일관되게 나타났다. [ 12 , 13 , 15 , 17 , 18 ]. 아래에 동물을 대상으로 한 이버멕틴의 항암 연구 결과에 대한 리뷰를 제시한다.
4.1 교모세포종
두 개의 독립적인 교모세포종 이종이식 SCID 마우스 모델이 U87 또는 T98G 세포의 피하 주사에 의해 확립되었고, 설치류는 후속적으로 40mg/Kg의 복강내 이버멕틴으로 처리되었다. 처리된 마우스는 상당한 종양 성장 억제를 나타내었지만 정상적인 행동을 유지하고 체중을 유지했다[ 12 ]. 3mg/Kg의 이버멕틴을 사용한 별도의 연구에서는 종양 크기가 50% 감소한 것으로 나타났으며 10mg/Kg에서 종양이 거의 완전히 사라졌다. Ki67 염색은 또한 대조군에 비해 이버멕틴 처리 동물에서 신경교종 세포 증식이 감소되었음을 확인했다[ 17 ].
4.2 결장암과 폐암
Melotti et al.등은 H358 인간 전이성 폐 기관지 폐포 암종 세포와 DLD1 결장직장 선암종 세포를 사용하여 이버멕틴의 항종양 효과를 테스트했다. 동물은 종양 확립 후 10mg/kg으로 매일 사이클로덱스트린-접합 이버멕틴의 복강 주사를 받았다. 그 후 종양이 이버멕틴에 반응하여 성장이 거의 50% 감소하고 폐암 WNT-TCF 서명이 억제되었으며 p21 수준이 향상되었음을 발견했다[ 13 ].
4.3 유방암
Ivermectin은 NOD-SCID 마우스의 유선 지방 패드에 피하 주사된 인간 MDA-MB-231 세포를 사용하여 동소 유방암 모델에서 평가되었습니다. ivermectin을 처리한 이종이식편은 대조군에 비해 성장 속도가 느리고 대조군 종양의 크기와 무게는 ivermectin 처리한 종양보다 거시적으로 더 컸다[ 15 ]. 또 다른 연구에서는 3mg/Kg의 이버멕틴을 투여한 Balb/c 마우스에서 JC 뮤린 유방암 세포를 테스트했다. 대조군과 비교할 때 연구 동물의 체중이나 행동의 변화 없이 치료가 종양 크기를 60% 이상 감소시켰다[ 22]. 최근에 5mg/Kg 용량의 이버멕틴이 4 T1 뮤린 종양 모델에서 다수의 종양내 CDA4+ 및 CD8+ T세포와 함께 면역원성 세포 사멸 특징을 유도한다는 것이 입증되었다. 따라서 이버멕틴은 차가운 종양을 뜨거운 종양으로 바꾸어 체크포인트 억제제인 니볼루맙과 현저한 시너지를 일으켜 주요 항종양 효과와 가장 중요한 보호 면역을 유도한다[ 26 ].
4.4 백혈병
인간 백혈병(OCI-AML2 및 K562) 및 쥐 백혈병(MDAY-D2) 세포를 NOD/SCID 마우스에 피하 주사한 후, 3mg/Kg(인간 등가 용량 0.240 mg/Kg)의 이버멕틴으로 처리하고 대조군은 구강 위관영양법을 통한 물로 처리했다. 추적 관찰에서, 처리된 마우스는 기관 독성의 어떠한 총체적 징후 없이 종양 부담이 최대 70% 감소했으며, 치료는 OCI-AML2 이종이식편에서 세포자멸사를 증가시켰다[ 18 ]. 대부분의 생체 내 연구에서 3-10mg/Kg 범위의 이버멕틴 용량의 항종양 효과를 평가한다는 점에 유의해야 한다. 이 마우스 용량은 인간에 대해서는 임상적으로 달성 가능한 0.240 ~ 0.810 mg/Kg으로 해석됩니다[ 27 ].
5. 이버멕틴의 임상 경험
위에서 언급한 바와 같이, 이버멕틴은 항기생충제로 임상적으로 광범위하게 사용되어 왔으며, 이 약물은 인간의 다른 병원체 및 비기생충 상태에 대한 용도로 그 용도가 변경되었다. 그러나 이버멕틴의 항종양 효과에 대한 상당한 전임상 증거에도 불구하고 암에 대한 이버멕틴의 임상 연구가 보고되지 않았으며 임상 시험이 시작되지 않았다는 사실은 매우 궁금한 점이다. 그러나 난치성 및 전치료가 심한 급성 골수아구성 백혈병을 앓는 3명의 소아에 대한 증례 보고가 있다. 비록 일화이긴 하지만, 세 가지 경우에서 이버멕틴은 단독으로 또는 Ara-C와 함께 1mg/Kg이었다. 그들 중 2명은 지속성 안정 질환으로 임상 개선을 보였고, 2명은 완전한 혈액학적 반응을 보였다. 이버멕틴만 투여받은 세 번째 환자는 반응이 없었다.28 ].
여기에서 우리는 이버멕틴의 독성, 안전성, 임상 약리학에 특별한 주의를 기울이면서 구충제로서의 이버멕틴과 다른 용도 변경 적응증에서의 임상 경험을 간략하게 검토한다. 이 데이터는 암에 대한 이버멕틴의 향후 임상 시험의 기초가 될 수 있다.
5.1 구충제로서의 이버멕틴 사용
광범위한 적용 가능성으로 인해 이버멕틴은 사상충증, 림프 사상충증, 스트롱길로이드증, 회충증, 옴, 장염 치료에 적용될 수 있다. 이버멕틴은 발견 이후 전 세계적으로 위의 기생충 감염을 앓고 있는 수백만 명의 환자에게 투여되었다. 특정 기생충에 대한 경구 이버멕틴 요법의 가벼운 부작용은 일반적으로 확인되어 왔다. 그들 중 많은 수가 치료 시작 후 24-48시간 이내에 나타나며 섬모충증의 경우 피부의 미세사상충 부하 및 이버멕틴 용량과 관련이 있다 . 이러한 부작용 중 일부는 근육통, 피부 발진, 관절 부기, 팔다리 또는 얼굴 가려움증, 발열 및 오한을 포함한다. 이러한 효과는 일반적으로 일시적이며 치료가 필요하지 않다[ 31 ,32 ]. 중등도에서 중증의 영향은 덜 일반적이며 통증, 관절통, 심한 현기증, 고열, 호흡곤란 및 저혈압이 있는 피부 부종을 포함할 수 있다(Mazzotti's Reaction). 이러한 반응은 Ivermectin의 투여와 관련이 있는 것이 아니라 숙주에 존재하는 기생충의 양과 관련이 있는 것으로 알려져 있다[ 30 , 31 ]. Mazzotti의 반응 외에도 사상충증 및 사상충증 환자에서 이버멕틴 치료 후 치명적일 수 있는 중증 뇌병증 사례가 있었다. 뇌병증의 증상에는 이버멕틴 치료 후 48시간 동안 정신 상태의 변화, 요실금, 서있거나 걷는 데 어려움 등이 포함된다. [ 32 , 33]. 이 효과는 아마도 이버멕틴 자체에 의한 것이 아니라 마비되거나 사멸된 기생충의 축적으로 인한 대뇌 미세순환 장애 때문일 것이다. [ 34,35 ] . 또한 독성 효과는 이버멕틴과 P-당단백질의 상호작용과 관련이 있다[ 8 ]. P-당단백질의 부재는 그것을 발현하지 않는 형질전환 마우스와 손상된 P-당단백질 기능(일반적으로 정지 코돈을 생성하는 MDR-1 유전자의 4개 염기쌍 결실)이 있는 개의 뇌에서 Ivermectin의 축적을 결정한다. 이버멕틴에 대한 신경 독성이 증가했다[ 36 ]. 표 2는 이버멕틴의 부작용을 요약한다. 용량과 일정은 다양하지만 사람 용량은 0.15~0.4mg/Kg 범위 내에서 승인된 적응증에 대해 표준화되어 있다. 사상충증의 경우 권장 용량은 12개월에 한 번 0.15mg/Kg이지만 심한 안구 감염이 있는 환자는 3~6개월마다 재치료가 필요할 수 있다. 사상충증은 일반적으로 0.4 mg/Kg의 단일 용량이 필요하다. 스트롱일로이드증에서는 0.2 mg/Kg의 단일 용량이 권장된다. 그러나 면역저하(HIV 포함) 환자의 경우 반복 투여(즉, 2주마다)와 지속적인 억제 요법(즉, 한 달에 한 번)이 필요할 수 있다. 0.2 mg/Kg의 단일 용량도 ascariasis 치료에 사용되는 반면, scabiasis에는 2주에 한 번 동일한 용량을 반복하는 것이 권장된다[ 37 ].
| 그룹 | 복용량(mg/kg) | 약물전달 | Cmax(ng/mL | Tmax (h) | AUC μg/h/mL |
| 사상충증 환자 | 0.1–0.2 | 경구 | 52.0 | 5.2 | 2.852 |
| 건강한 자원봉사자 | 0.35–0.6 | 경구 | 87.0 | 4.2 | 1.444 |
| 건강한 자원봉사자 | 0.7–1.1 | 경구 | 165.2 | 3.6 | 2.099 |
| 건강한 자원봉사자 | 1.4–2.0 | 경구 | 247.8 | 4.2 | 4.547 |
표 2. 기생충에 감염된 인간과 건강한 지원자에서 Ivermectin의 약동학 데이터.
최근에는 토양 전달 기생충 및 말라리아와 같은 이버멕틴의 새로운 항기생충 적응증에 대한 관심이 높아져 0.4mg/Kg 이상의 용량이 더 높은 혈장 수준을 달성하기 위해 평가되고 있다[ 38 , 39 ].
예를 들어 18mg 및 36mg 고정 요법의 안전성을 평가하기 위해 54명의 건강한 성인 지원자에게 18mg 이버멕틴 정제를 사용한 약동학 시험이 있다[ 40]. 고용량의 이버멕틴의 안전성을 조사하기 위한 메타 분석에서 포함할 4개의 연구를 확인했으며 고용량에서 부작용을 경험하는 개인의 수에는 차이가 없음을 발견했다. 다양한 적응증에 대한 이러한 임상 시험의 기술 분석에서도 표준(최대 0.4mg/Kg)과 고용량의 이버멕틴(0.4-0.7mg/Kg, 0.6mg/Kg 및 0.8 mg/Kg) 간에 이상 반응의 심각성에 차이가 없음을 보여주었다. 한 시험에서만 사상충증을 치료하기 위한 시험에서 고용량 그룹에서 일시적인 시야 흐림, 눈의 가려움 또는 통증, 색각이상증과 같은 일시적이고 경증에서 중등도의 주관적 안구 현상이 증가하는 것으로 나타났다. 한편, 생명에 위협적인 것으로 묘사된 심각한 부작용은 표준 선량에서 아나필락시스 1건, 고선량 그룹에서 약물-약물 상호작용에 의한 QTc 연장 1건으로 4건의 연구 중 1건에서만 보고되었다[41]. 이 작은 메타 분석의 결과는 더 높은 용량의 이버멕틴이 상대적으로 안전함을 시사해 준다.
5.2 항바이러스제로서의 이버멕틴의 잠재력
Ivermectin은 시험관 내 그리고 생체 내 연구 모두에서 바이러스에 대한 항바이러스 활성을 나타낸다. 항바이러스 활성은 karyopherin α/β-1 heterodimerization으로 알려진 포유류 숙주 임포틴에 의해 촉진되는 바이러스 단백질의 핵 전위 억제와 관련이 있는 것으로 생각된다[ 42 ]. 이버멕틴이 현재 COVID-19 대유행에서 치료제로 테스트된 것은 부분적으로 이를 기반으로 한다. 4건의 관찰 연구(대조군 포함 3건, 포함하지 않은 1건)에서 629명의 COVID-19 환자를 대상으로 한 최근 메타 분석 및 체계적인 검토에 따르면 이버멕틴을 추가하면 대조군에 비해 상당한 임상 개선이 나타났다(OR=1.98, 95% CI: 1.11 - 3.53, p=0.02) [ 43]. 그러나 저자는 근거의 질이 낮기 때문에 해석에 주의가 필요하고 분석에 포함된 시험 중 하나가 이후에 철회되었다는 점에 유의해야 한다. 한편, COVID-19에 대해 이버멕틴을 평가하는 여러 무작위 연구가 최근에 발표되었다. 이란의 한 시험에서 이버멕틴 0.2mg/Kg의 단일 용량이 COVID-19 증상이 있는 환자에서 내약성이 우수했으며 COVID-19와 관련된 호흡곤란, 기침 및 림프구감소증이 유의하게 개선되었음을 보여주었다[ 44 ]. 다른 2건의 무작위 시험에서 바이러스 제거 시간이 통계적으로 단축되었다. 이 두 시험의 용량과 일정은 5일 동안 매일 고정된 12mg의 이버멕틴[ 45 ]과 입원 시 1회 0.1, 0.2 및 0.4mg/Kg의 이버멕틴 [45]이었다.46 ]. 이는 검증되지 않은 시험이었으므로 다양한 COVID-19 임상 시나리오에서 이버멕틴의 임상적 유용성을 확인하기 위해서는 추가 증거가 여전히 필요하다.
6. 암 치료제로서의 이버멕틴의 약동학 및 용량 고려사항
광범위한 사용의 비교적 오랜 역사로 인해 이버멕틴의 약동학은 잘 연구되어 있다. 경구 경로는, 피하 투여할 수 있고 정맥 투여 경로도 조사되었지만 인간에 대한 이버멕틴 투여에 대해 유일하게 승인되었다. 이버멕틴은 지용성 화합물로 경구투여 후 4~5시간 후에 최고농도에 도달하며 반감기는 약 19시간이다. 투여 후, 이는 이후 시토크롬 P-4503A4에 의해 인간의 간 마이크로솜에서 광범위하게 대사되어 약물을 적어도 10개의 대사 산물로 전환하며, 그 대부분은 수산화 및 탈메틸화된 유도체이다. 배설은 주로 대변을 통해 이루어지며 1%만이 소변으로 배설된다[ 49]. 0.150 mg/Kg의 Ivermectin을 투여한 건강한 개인과 사상충증에 감염된 환자에서 흡수, 분포, 대사 및 배설과 같은 약동학적 매개변수의 유의한 변동성은 관찰되지 않았다[ 49 ].
인간 사용을 위한 구충제로서 이버멕틴의 치료 용량은 0.1~0.4mg/Kg[ 4 , 5 , 6 , 7 ]이며, AUC는 1,444㎍/h/mL입니다. 1.65μM의 혈장 농도로 해석되는 이 약물 노출은 종양 세포를 억제하는 데 필요한 것으로 밝혀진 5μM 이상의 농도보다 적다. 시험관 내 건강한 지원자를 대상으로 한 1상 약동학 연구에서 AUC가 4,547μg/h/mL인 최대 2mg/Kg의 용량이 5μM의 혈장 농도로 변환될 수 있음이 입증되었다[ 50 ]. 암 치료를 위한 용량은 2 mg/kg 이상이어야 한다.
7. 토론
현재 암에 대한 약물 용도 변경 후보의 발견을 촉진하기 위한 다양한 노력과 많은 약물 후보가 존재한다[ 51 ]. 예를 들어, 연구원, 임상의 및 암 환자 옹호자들의 비영리 국제 협력에 의해 시작된 Repurposing Drugs in Oncology(ReDO) 프로젝트는 효과적이고 독성이 최소화되고 저렴한 암 치료법을 찾는 것을 목표로 한다. 다음 두 가지 기준과 일치하는 268개 약물 중 : i) 해당 약물은 전 세계 최소 한 국가에서 비암 적응증에 대한 라이선스가 있고, ii) 해당 약물은 하나 이상의 악성 종양에 대한 시험관 내 및 생체 내 혹은 임상연구에서 특정 항암의 효과를 제시한 바 있는 하나 이상의 동료 심사를 받아 출간된 주제이다. 이러한 기준에 따르면 이버멕틴은 암의 잠재적 용도 변경 후보가 될 수 있다. Ivermectin은 광범위한 전임상 시험관 내 및 생체 내 항암 데이터를 갖춘, 임상 시험에 이상적인 후보이다. 이버멕틴의 특히 유망한 특징은 시험관 연구에서의 항암 농도가 내임상적으로 저렴하게 그리고 과도한 독성 없이 달성할 수 있다는 점이다.
8. 결론
Ivermectin은 광범위한 임상 안전성을 나타내는 구충제로 수백만 명의 환자에게 투여되어 왔다. 이버멕틴의 항종양 잠재력을 입증하는 시험관 내 그리고 생체 내 증거가 대규모 체계로 존재하며, 이버멕틴의 항종양 효능은 임상 약동학을 기반으로 임상적으로 달성 가능한 농도에서 입증될 수 있다는 점 역시 그러하다. 따라서 우리는 이버멕틴이 단일 약제로서 또는 기존의 암에 대한 항종양제와 조합하여 임상 시험을 위해 긴급히 고려될 것을 제안한다.
*참고 자료
- 1.Omura S, Crump A (2004) The life and times of Ivermectin - a success story. Nat Rev Microbiol 2 (12):984-989.
- 2.Omura S (2008) Ivermectin: 25 years and still going strong. Int J Antimicrob Agents 31 (2):91-98.
- 3.Chabala JC, Mrozik H, Tolman RL, Eskola P, Lusi A, Peterson LH, Woods MF, Fisher MH, Campbell WC, Egerton JR, Ostlind DA (1980) Ivermectin, a new broad-spectrum antiparasitic agent. J Med Chem 23 (10):1134-1136.
- 4.Goa KL, McTavish D, Clissold SP (1991) Ivermectin. A review of its antifilarial activity, pharmacokinetic properties, and clinical efficacy in onchocerciasis. Drugs 42 (4):640-658.
- 5.Kumaraswami V, Ottesen EA, Vijayasekaran V, Devi U, Swaminathan M, Aziz MA, Sarma GR, Prabhakar R, Tripathy SP (1988) Ivermectin for the treatment of Wuchereria bancrofti filariasis. efficacy and adverse reactions. JAMA 259 (21):3150-3153
- 6.Marti H, Haji HJ, Savioli L, Chwaya HM, Mgeni AF, Ameir JS, Hatz C (1996) A comparative trial of a single-dose ivermectin versus three days of albendazole for treatment of Strongyloides stercoralis and other soil-transmitted helminth infections in children. Am J Trop Med Hyg 55 (5):477-481.
- 7.Whitworth JA, Morgan D, Maude GH, McNicholas AM, Taylor DW (1991) A field study of the effect of Ivermectin on intestinal helminths in man. Trans R Soc Trop Med Hyg 85 (2):232-234.
- 8.Zemkova H, Tvrdonova V, Bhattacharya A, Jindrichova M (2014). Allosteric modulation of ligand gated ion channels by ivermectin. Physiol Res 63: S215-S224.
- 9.Novac N. Challenges and opportunities of drug repositioning. Trends Pharmacol Sci 2013; 34: 267-72.
- 10.Juarez M, Schcolnik-Cabrera A, Duenas-Gonzalez A (2018) The multitargeted drug ivermectin: from an antiparasitic agent to a repositioned cancer drug. Am J Cancer Res 8(2):317-331
- 11.Dominguez-Gomez G, Chavez-Blanco A, Medina-Franco JL, Saldivar-Gonzalez F, Flores-Torrontegui Y, Juarez M, Diaz- Chavez J, Gonzalez-Fierro A, Duenas-Gonzalez A (2018) Ivermectin as an inhibitor of cancer stem-like cells. Mol Med Rep 17(2):3397-3403. doi: 10.3892/mmr.2017.8231.
- 12.Liu Y, Fang S, Sun Q, Liu B (2016) Anthelmintic drug ivermectin inhibits angiogenesis, growth and survival of glioblastoma through inducing mitochondrial dysfunction and oxidative stress. Biochem Biophys Res Commun 480(3):415-421.
- 13.Melotti A, Mas C, Kuciak M, Lorente-Trigos A, Borges I, Ruiz I Altaba A (2014) The river blindness drug Ivermectin and related macrocyclic lactones inhibit WNT-TCF pathway responses in human cancer. EMBO Mol Med 6(10):1263-1278.
- 14.Hashimoto H, Messerli SM, Sudo T, Maruta H (2009) Ivermectin inactivates the kinase PAK1 and blocks the PAK1-dependent growth of human ovarian cancer and NF2 tumor cell lines. Drug Discov Ther 3(6):243-246
- 15.Dou Q, Chen HN, Wang K, Yuan K, Lei Y, Li K, Lan J, Chen Y, Huang Z, Xie N, Zhang L, Xiang R, Nice EC, Wei Y, Huang C (2016) Ivermectin induces cytostatic autophagy by blocking the PAK1/Akt axis in breast cancer. Cancer Res 76(15):4457-446
- 16.Kwon YJ, Petrie K, Leibovitch BA, Zeng L, Mezei M, Howell L, Gil V, Christova R, Bansal N, Yang S, Sharma R, Ariztia EV, Frankum J, Brough R, Sbirkov Y, Ashworth A, Lord CJ, Zelent A, Farias E, Zhou MM, Waxman S (2015) Selective Inhibition of SIN3 corepressor with avermectins as a novel therapeutic strategy in triple-negative breast cancer. Mol Cancer Ther 14(8):1824-1836.
- 17.Yin J, Park G, Lee JE, Choi EY, Park JY, Kim TH, Park N, Jin X, Jung JE, Shin D, Hong JH, Kim H, Yoo H, Lee SH, Kim YJ, Park JB, Kim JH (2015) DEAD-box RNA helicase DDX23 modulates glioma malignancy via elevating miR-21 biogenesis. Brain 138(Pt 9):2553-2570.
- 18.Sharmeen S, Skrtic M, Sukhai MA, Hurren R, Gronda M, Wang X, Fonseca SB, Sun H, Wood TE, Ward R, Minden MD, Batey RA, Datti A, Wrana J, Kelley SO, Schimmer AD (2010) The antiparasitic agent ivermectin induces chloride-dependent membrane hyperpolarization and cell death in leukemia cells. Blood 116(18):3593-3603.
- 19.Draganov D, Gopalakrishna-Pillai S, Chen YR, Zuckerman N, Moeller S, Wang C, Ann D, Lee PP (2015) Modulation of P2X4/ P2X7/Pannexin-1 sensitivity to extracellular ATP via Ivermectin induces a non-apoptotic and inflammatory form of cancer cell death. Sci Rep 5:16222.
- 20.Fang F, Pan J, Li YP, Li G, Xu LX, Su GH, Li ZH, Feng X, Wang J (2016) p21-activated kinase 1 (PAK1) expression correlates with prognosis in solid tumors: A systematic review and meta-analysis. Oncotarget 10;7(19):27422-9.
- 21.Rosen JM, Jordan CT (2009) The increasing complexity of the cancer stem cell paradigm. Science 324:1670-1673.
- 22.Juarez M, Schcolnik-Cabrera A, Dominguez-Gomez G, Chavez-Blanco A, Diaz-Chavez J, Duenas-Gonzalez A. (2019). Antitumor effects of Ivermectin at clinically feasible concentrations support its clinical development as a repositioned cancer drug. Cancer Chemother Pharmacol 85(6):1153-1163.
- 23.Nishio, M. Sugimachi, K. Goto, H. Wang,J. Suzuki A. (2015). Dysregulated YAP/TAZ and TGF-B signaling mediate hepatocarcinogenesis in Mob1a/1b-deficient mice. Proceedings of the National Academy of Sciences of the United States of America 10:1073-1090.
- 24.Zhang P, Zhang Y, Liu K, Liu B, Xu W, Gao J, Ding L, Tao L (2019) Ivermectin induces cell cycle arrest and apoptosis of HeLa cells via mitochondrial pathway. Cell Prolif 52(2):e12543.
- 25.Song D, Liang H, Qu B, Li Y, Liu J, Zhang Y, Li L, Hu L, Zhang X, Gao A (2019) Ivermectin inhibits the growth of glioma cells by inducing cell cycle arrest and apoptosis in vitro and in vivo. J Cell Biochem 120(1):622-633
- 26.Draganov D, Han Z, Rana A, Bennett N, Irvine DJ, Lee PP (2021) Ivermectin converts cold tumors hot and synergizes with immune checkpoint blockade for treatment of breast cancer. NPJ Breast Cancer 7(1):22. doi: 10.1038/s41523-021-00229-5.
- 27.Reagan-Shaw S, Nihal M, Ahmad N (2008) Dose translation from animal to human studies revisited. FASEB J 22(3):659-61. doi: 10.1096/fj.07-9574LSF.
- 28.de Castro CG Jr, Gregianin LJ, Burger JA. (2020). Continuous high-dose ivermectin appears to be safe in patients with acute myelogenous leukemia and could inform clinical repurposing for COVID-19 infection. Leuk Lymphoma 61(10):2536-2537. doi: 10.1080/10428194.2020.1786559.
- 29.De Sole, G., et al., (1989) A community trial of Ivermectin in the onchocerciasis focus of Asubende, Ghana. II. Adverse reactions. Trop Med Parasitol 40(3):375-82.
- 30.De Sole, G., et al., (1990) Lack of adverse reactions in ivermectin treatment of onchocerciasis. Lancet 335(8697):1106-7.
- 31.Boussinesq, M., et al., (2006) What are the mechanisms associated with post-ivermectin serious adverse events? Trends Parasitol 22(6):244-6.
- 32.Boussinesq, M., et al., (2003) Clinical picture, epidemiology and outcome of Loa-associated serious adverse events related to mass ivermectin treatment of onchocerciasis in Cameroon. Filaria J Suppl 1: S4.
- 33.Twum-Danso NA (2003) Serious adverse events following treatment with Ivermectin for onchocerciasis control: a review of reported cases. Filaria J. Suppl 1:S3.
- 34.Madan V, Jaskiran K, Gupta U, Gupta DK. (2001) Oral Ivermectin in scabies patients: a comparison with 1% topical lindane lotion. J Dermatol 28(9):481-4.
- 35.Sparsa A1, Bonnetblanc JM, Peyrot I, Loustaud-Ratti V, Vidal E, Bédane C (2006) Systemic adverse reactions with ivermectin treatment of scabies. Ann Dermatol Venereol 2006 Oct;133(10):784-7.
- 36.Mealey KL, Bentjen SA, Gay JM, Cantor GH. Ivermectin sensitivity in collies is associated with a deletion mutation of the mdr1 gene. Pharmacogenetics 2001; 11: 727-33.
- 37.Ashour DS (2019) Ivermectin: From theory to clinical application. Int J Antimicrob Agents 54(2):134-142. doi: 10.1016/j.ijantimicag.2019.05.003.
- 38.Palmeirim MS, Hürlimann E, Knopp S, Speich B, Belizario V Jr, Joseph SA, Vaillant M, Olliaro P, Keiser J (2018) Efficacy and safety of co-administered ivermectin plus albendazole for treating soil-transmitted helminths: A systematic review, meta-analysis and individual patient data analysis. PLoS Negl Trop Dis 12(4):e0006458. doi: 10.1371/journal.pntd.0006458.
- 39.Chaccour C, Hammann F, Rabinovich NR (2017) Ivermectin to reduce malaria transmission I. Pharmacokinetic and pharmacodynamic considerations regarding efficacy and safety. Malar J 16(1):161. doi: 10.1186/s12936-017-1801-4.
- 40.Muñoz J, Ballester MR, Antonijoan RM, Gich I, Rodríguez M, Colli E, Gold S, Krolewiecki AJ (2018) Safety and pharmacokinetic profile of fixed-dose ivermectin with an innovative 18 mg tablet in healthy adult volunteers. PLoS Negl Trop Dis 18;12(1):e0006020. doi: 10.1371/journal.pntd.0006020.
- 41.Navarro M, Camprubí D, Requena-Méndez A, Buonfrate D, Giorli G, Kamgno J, Gardon J, Boussinesq M, Muñoz J, Krolewiecki A (2020) Safety of high-dose ivermectin: a systematic review and meta-analysis. J Antimicrob Chemother 75(4):827-834. doi: 10.1093/jac/dkz524.
- 42.Kinobe RT, Owens L (2021) A systematic review of experimental evidence for antiviral effects of ivermectin and an in silico analysis of ivermectin’s possible mode of action against SARS-CoV-2. Fundam Clin Pharmacol 35(2):260-276. doi: 10.1111/fcp.12644.
- 43.Padhy BM, Mohanty RR, Das S, Meher BR (2020) Therapeutic potential of Ivermectin as add on treatment in COVID 19: A systematic review and meta-analysis. J Pharm Pharm Sci 23:462-469. DOI: 10.18433/jpps31457.
- 44.Shahbaznejad L, Davoudi A, Eslami G, Markowitz JS, Navaeifar MR, Hosseinzadeh F, Movahedi FS, Rezai MS (2021) Effects of Ivermectin in Patients With COVID-19: A Multicenter, Double-Blind, Randomized, Controlled Clinical Trial. Clin Ther S0149-2918(21)00201-0. doi: 10.1016/j.clinthera.2021.04.007.
- 45.Ahmed S, Karim MM, Ross AG, Hossain MS, Clemens JD, Sumiya MK, Phru CS, Rahman M, Zaman K, Somani J, Yasmin R, Hasnat MA, Kabir A, Aziz AB, Khan WA (2020) A five-day course of Ivermectin for the treatment of COVID-19 may reduce the duration of illness. Int J Infect Dis 103:214-216. DOI: 10.1016/j.ijid.2020.11.191.
- 46.Pott-Junior H, Bastos Paoliello MM, Miguel AQC, da Cunha AF, de Melo Freire CC, Neves FF, da Silva de Avó LR, Roscani MG, Dos Santos SS, Chachá SGF (2021) Use of ivermectin in the treatment of Covid-19: A pilot trial. Toxicol Rep 8:505-510. doi: 10.1016/j.toxrep.2021.03.003.
- 47.Zemkova H, Tvrdonova V, Bhattacharya A, Jindrichova M (2014) Allosteric Modulation of Ligand Gated Ion Channels by Ivermectin. Physiol Res 63: S215-S224.
- 48.Costa JL, Diazgranados JA (1994) Ivermectin for spasticity in spinal-cord injury. Lancet 343 (8899): 739. doi: 10.1016/s0140-6736(94)91625-x.
- 49.Baraka OZ, Mahmoud BM, Marschke CK, Geary TG, Homeida MM, Williams JF (1996) Ivermectin distribution in the plasma and tissues of patients infected with Onchocerca volvulus. Eur J Clin Pharmacol 50(5):407-10.
- 50.Guzzo CA, Furtek CI, Porras AG, Chen C, Tipping R, Clineschmidt CM, Sciberras DG, Hsieh JY, Lasseter KC (2002) Safety, tolerability, and pharmacokinetics of escalating high doses of Ivermectin in healthy adult subjects. J Clin Pharmacol 42 (10):1122-1133.
- 51.Pantziarka PS, Meheus L, Sukhatme VP, Bouche G. Repurposing non-cancer drugs in oncology-How many drugs are out there? bioRxiv 2017; 197434.doi: https://doi.org/10.1101/197434